Medzi nami atómami
Tabuľky čokolády nám naznačujú, že je možné sa o ňu podeliť. Ale čo vtedy, keď zostane posledný kúsok? Ak máme nôž, tak nie je problém rozdeliť ho na dva menšie. A potom ešte menšie. Existuje posledný kúsok?
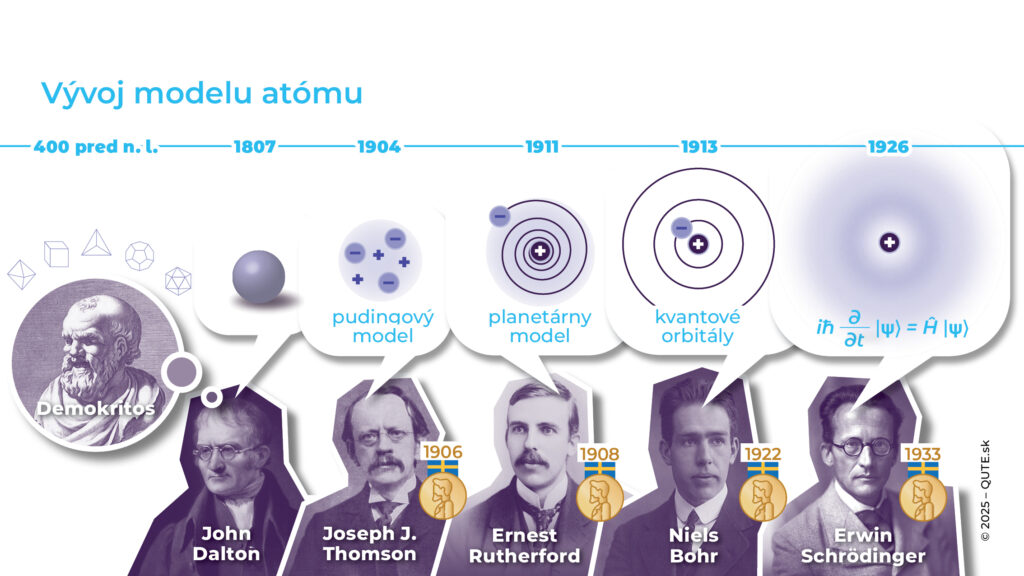
Vývoj predstáv o atóme.
Od tvaru ku náboju jadra
Starogrécky filozof Demokritos si predstavoval svet, v ktorom posledný nedeliteľný kúsok existuje a pomenoval ho “nekrájateľný, nedeliteľný” – po grécky átomos. Taktiež tvrdil, že atómy nie sú spolu natesno pozliepané, ale že priestor medzi nimi vypĺňa prázdno. Vlastnosti látok podľa jeho filozofie určovali tvary atómov – napríklad atómy ohňa boli ostré. Začiatkom 19. storočia myšlienka atómov pomohla vedcom pochopiť pravidlá chemických procesov. V roku 1808 John Dalton na základe svojich pozorovaní sformuloval teóriu, podľa ktorej sú chemické látky zoskupeniami elementárnych prvkov, ktoré sa vyskytujú v zlúčeninách v celočíselných pomeroch. Vediaco Demokritovi ich pomenoval atómy. Pri chemických reakciách prichádza k preskupovaniu týchto atómov, čím sa menia ich pomery a aj chemické zlúčeniny.
Počas 19. storočia sa postupne podarilo identifikovať rôzne atómy. Analýzou chemických reakcií sa podarilo určiť ich relatívne hmotnosti. Chemici si ďalej všimli, že v usporiadanom zozname atómov podľa ich hmotnosti, sa isté chemické vlastnosti prvkov opakujú. V roku 1869 Dmitrij I. Mendelejev publikoval periodickú tabuľku chemických prvkov. Periodicita chemických vlastností naznačuje, že svet atómov má nejaké pravidlá. Pochopiť nám ich pomohla až kvantová fyzika o 57 rokov neskôr.

Periodická tabuľka chemických prvkov. Prvý zoznam prvkov pochádza od J. Daltona. D. I. Mendelejev pri usporadúvaní predpovedal štyri nové prvky (dnes známe ako skandium, gálium, germánium a technécium), ktoré vyplnili vynechané miesta v tabuľke, čím potvrdili jej relevantnosť.
V roku 1897 Joseph J. Thompson experimentálne potvrdil, že katódové žiarenie má hmotnosť a je zložené z korpuskúl, ktoré majú 1800-krát menšiu hmotnosť ako najľahší známy atóm – vodík. Korpuskuly sú elektricky nabité a správne ich identifikoval s elektrónmi – časticami elektrického prúdu, ktoré predpovedal Goerge J. Stoney v roku 1874. Keďže katódové žiarenie je emitované atómami katódy, tak sa elektróny musia v týchto atómoch nachádzať a z atómu sa dá niečo “odkrojiť”.
Otázku, akým spôsobom sú elektróny obsiahnuté v atómoch, neskôr experimentálne študoval Ernest Rutherford. Pomocou rádioaktívneho alfa žiarenia v roku 1909 objavil, že pozitívny náboj je sústredený v relatívne malej, centrálnej časti atómu. Objavil, že atóm má pozitívne nabité jadro, okolo ktorého sa pohybujú ľahké elektróny. V roku 1911 právnik a amatérsky fyzik Antonius J. van den Broek navrhol preusporiadať prvky v periodickej tabuľke podľa veľkosti náboja jadra atómov (E. Rutherford ho nazval atómovým číslom), čím získala svoju dnešnú podobu.
Predpovede a realita
Chemickú periodicitu a vlastnosti atómov vysvetľuje základná rovnica kvantového sveta – Schrödingerova rovnica. Podľa tejto rovnice je atóm vodíka systémom kladne nabitého protónu a negatívne nabitého elektrónu so zanedbateľnou hmotnosťou. Príťažlivá elektrická sila vytvára podobný fyzikálny systém ako gravitačná sila medzi Slnkom a Zemou. Rovnice fyziky 19. storočia však predpovedajú pre takýto planetárny model atómu “katastrofický” scenár. Elektrón pohybujúci sa okolo jadra nutne stráca energiu formou elektromagnetického žiarenia. Tým stráca svoju rýchlosť a za neuveriteľných 10-11 sekundy spadne do jadra. Nič takéto sa však nedeje.
Niels Bohr vo svojom vysvetlení atómu vodíka jednoducho takéto žiarenie elektrónom zakázal. Spojil vyžarovanie s myšlienkou fotónu a identifikoval, že atómy vyžarujú iba fotóny určitých frekvencií, čo je spojené so skokovými zmenami ich energií. V Bohrovom modeli elektróny obiehajú okolo jadra iba po istých orbitách. Množinu vyžarovaných frekvencií nazývame spektrom a každý atóm má toto spektrum iné. Napríklad prítomnosť žltej frekvencie 510,29 THz v žiarení zo Slnka viedla v roku 1868 k objavu nového “mimozemského” prvku – hélia. Podľa spektier dnes identifikujeme atómy a molekuly, a tak dokážeme usudzovať o chemickom zložení vzdialených hviezd a galaxií.
Schrödingerova rovnica skutočne predpovedá, že elektróny a protóny atómu majú isté preferované energie a vyžarovanie nastáva iba v prípade, ak je atóm v excitovanom stave. V bežných podmienkach sú excitované výlučne elektróny najviac vzdialené od jadra. Keď excitovaný elektrón “preskočí” na nižšiu energetickú hladinu, tak atóm stratí energiu vo forme vyžiarenia jedného fotónu s energiou E rovnajúcou sa stratenej energii. Frekvencia vyžiareného fotónu je daná Planckovým vzťahom E=hf, kde h je Planckova konštanta.
Kvantovanie sveta
Kvantová fyzika nás naučila, že nielen žiarenie, ale aj hmota sú kvantované a nemôžeme ich deliť donekonečna. Atómy však nie sú nedeliteľné. Skladajú sa z elektrónov, protónov a neutrónov. Dnes máme predstavu, že elektróny už viac deliť nejde, ale protóny a neutróny sú zložené z kvarkov. Okrem tabuľky elementárnych prvkov máme aj tabuľku elementárnych častíc, ale situácia s chápaním toho, čo sa z čoho skladá, sa nám skomplikovala. Je logické povedať, že ak sa X rozpadne na A a B, tak X je zložené z A a B. Kvantový svet však úplne nezdieľa takúto logiku na úrovni častíc. Existujú kryštály, v ktorých sa ultrafialový fotón rozpadne na dva červené fotóny, ale to neznamená, že ultrafialový fotón sa skladá z dvoch červených. Iba platí, že energia dvoch červených je rovnaká ako energia ultrafialového fotónu. Môžeme povedať, že energia nielen mení formu, ale sa aj oblieka do rôznych častíc bytia. Pre samotné častice prichádza k ich premenám – vzniku a zániku. Napríklad voľný neutrón sa pri beta rozpade premení na protón, elektrón a antineutríno.
Kvantovanie sveta motivované delením látok prijalo myšlienku častíc ako základných stavebných kameňov nášho sveta. Kvantovanie však pozorujeme pre všetky fyzikálne veličiny. V praxi to znamená, že pre rôzne systémy môžu niektoré veličiny nadobúdať iba určité hodnoty. Nie vždy sú tieto hodnoty celočíselnými násobkami akéhosi základného kvanta tejto veličiny. Napríklad prípustné hodnoty energie atómu vodíka sú 1/n2 násobkami (n = 1, 2, 3, … ) energie -13.6 eV a vyžiarené fotóny majú frekvencie úmerné rozdielom týchto energií. Kvantovanie energie atómov obsiahnuté v Schrödingerovej rovnici vyriešilo problém rovníc klasickej fyziky.
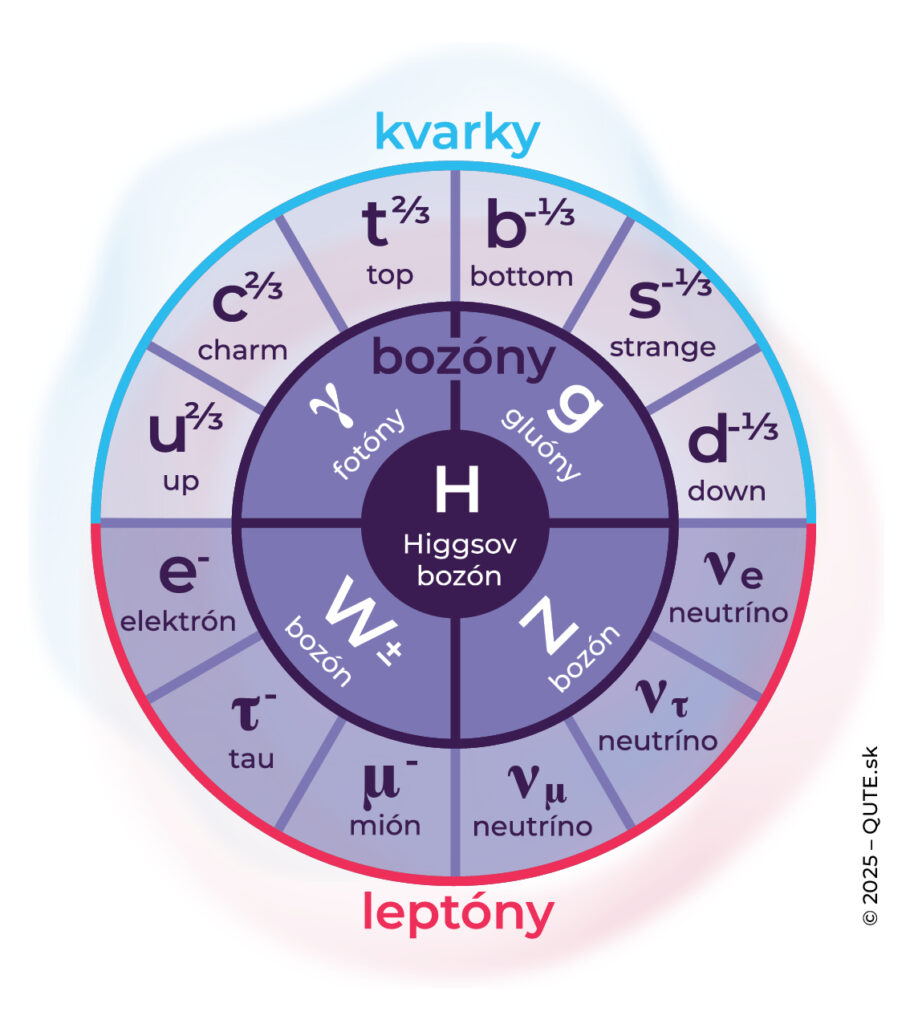
Tabuľka elementárnych častíc podľa tzv. štandardného modelu. Vonkajší kruh tvoria fermióny so spinom ½. Vnútorný kruh tvoria “interakčné” bozóny s jednotkovým spinom a Higgsov bozón v strede má nulový spin. Horný index zodpovedá elektrickému náboju.
Počítanie času
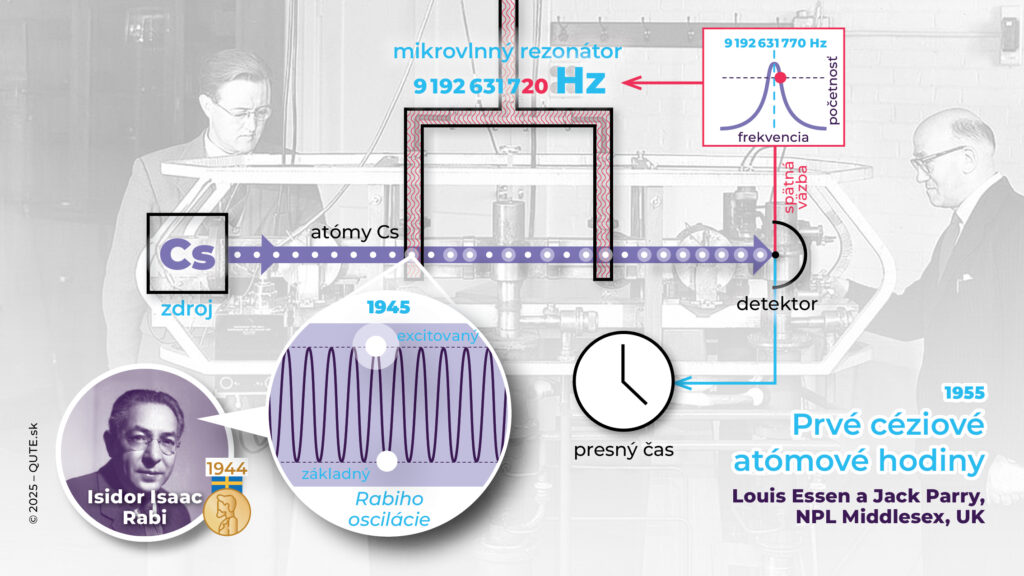
Zjednodušený princíp fungovania atómových hodín. V roku 1945 navrhol Isaac Rabi využiť oscilačné frekvencie atómov k udržovaniu stability merania času. Prvé céziové atómové hodiny zostrojili v roku 1955 Louis Essen a Jack Parry v Anglicku.
Céziové atómové hodiny určujú presný čas celosvetovo už vyše 60 rokov. Majú chybovosť 1 s za niekoľko miliónov rokov (zopár nanosekúnd za deň). Presná synchronizácia, ktorú nám umožňujú, je kľúčová pre fungujúci vysokorýchlostný internet. Bez presnosti atómových hodín by globálne navigačné systémy nemali presnosť metrov, ale kilometrov.
Ďalšia generácia tzv. optických atómových hodín využíva energetické hladiny spojené s fotónmi viditeľných frekvencií, čím zlepšuje presnosť tých céziových až stotisíckrát. Okrem očakávaného spresnenia definície sekundy, sa budú hodiť aj pre presnejšiu navigáciu vo vesmíre.
Autor článku: Mário Ziman, Fyzikálny ústav SAV, v.v.i. v Bratislave
Ilustrácie: Diana Cencer Garafová, QUTE.sk – Národné centrum pre kvantové technológie
Zdroje obrázkov: wikipédia public domain


